Unbedachtes Warenverzeichnis? – Gufic
Der Fall: Die indische Gufic Biosciences Ltd. bemühte sich, für ihre Produktmarke ein unbedachtes Warenverzeichnis zu vermeiden. Sie verkauft in Deutschland Weihrauchtabletten. Diese enthalten als Wirkstoff das Harz der Weihrauchpflanze Boswellia serrata. Die Tabletten werden unter anderem mit der Unionsmarke
![]()
gekennzeichnet. Die Marke hatte Gufic Biosciences gleich für eine Vielzahl von Waren registrieren lassen, darunter für „Weihrauch“ und „Kosmetikartikel“ in der Nizza-Klasse 3 und für „Arzneimittel“ und „Nahrungsergänzungsmittel“ in der Nizza Klasse 5. War sie damit auf der sicheren Seite?
Die deutsche Hecht-Pharma GmbH stellte einen Antrag auf Erklärung des Verfalls wegen Nichtbenutzung.
Gufic Biosciences konnte nachweisen, dass die Marke als selbstständiges Kennzeichen auf den Verpackungen der Weihrauchtabletten angebracht war, und zwar sowohl auf dem Präparat „Sallaki TABLETS“

als auch auf dem Präparat „H15 Gufic“
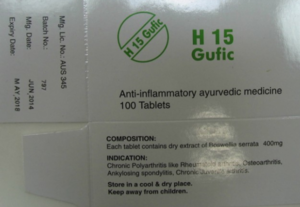
Auch reichte die nachgewiesene Vermarktung der Produkte für eine rechtserhaltende Benutzung der Marke an sich aus.
Aber wurden die Tabletten auch für die registrierten Produkte benutzt? Gufic Biosciences berief sich darauf, ihre Weihrauchtabletten seien Arzneimittel und die Marke werde daher für Arzneimittel benutzt. Aber in der Europäischen Union sind die Weihrauchtabletten gar nicht als Arzneimittel zugelassen! Nur in Indien ist das der Fall.
Hecht Pharma machte geltend, den Tabletten fehle auch die für Arzneimittel erforderliche pharmakologische Wirkung. Und die arzneimittelrechtliche Zulassung sei wegen Bedenklichkeit des Wirkstoffs in Deutschland sogar rechtskräftig versagt worden! Als bedenkliche Arzneimittel dürften die Tabletten gar nicht vertrieben werden. Es sei somit unmöglich, dass die Marke gleichwohl für Arzneimittel benutzt worden sein könnte. Die Marke müsse für Arzneimittel gelöscht werden.
Ist das richtig?
Die Europäische Arzneimittelrichtlinie 2001/83 (EG) kennt zwei Definitionen von Arzneimitteln. Zunächst sind dieses die sog. Funktionsarzneimittel, pharmazeutische Erzeugnisse also mit erheblicher pharmakologischer Wirkung auf den menschlichen Körper. Daneben definiert die Arzneimittel-Richtlinie als Arzneimittel auch die sog. Präsentationsarzneimittel. Diese Erzeugnisse besitzen zwar nicht die pharmakologische Wirksamkeit eines Funktionsarzneimittels. Aber sie erwecken aufgrund ihrer äußeren Form und Aufmachung den (falschen) Eindruck, als würden sie – wie ein Funktionsarzneimittel – der Heilung oder Verhütung von menschlichen Krankheiten dienen. Vor solchen Erzeugnissen will die Richtlinie den Verbraucher schützen, weshalb sie solche Erzeugnisse ebenfalls als Arzneimittel einstuft.
Kommt es im Markenrecht jedoch auf diese arzneimittelrechtliche Differenzierung überhaupt an?
Die Arzneimittelrichtlinie verfolgt ganz andere Ziele als das Markenrecht. Die Richtlinie soll den freien Verkehr mit Arzneimitteln in der Europäischen Union unter Berücksichtigung des Schutzes der öffentlichen Gesundheit verwirklichen. Demgegenüber soll das Markenrecht Produkte nach ihrer betrieblichen Herkunft unterscheiden. Die Einstufung eines Produkts nach anderen Vorschriften des Unionsrechts ist für die markenrechtliche Beurteilung deshalb grundsätzlich unbeachtlich!
Allerdings lässt sich feststellen, dass sowohl das Markenrecht wie das Arzneimittelrecht bei den Präsentationsarzneimitteln entscheidend auf die Verbrauchersicht abstellen. So beurteilt sich die Verwechslungsgefahr im Markenrecht aus der Sicht der Verbraucher. Und auch Präsentationsarzneimittel sind nur deshalb Arzneimittel, weil sie aufgrund ihres Erscheinungsbildes von den Verbrauchern dafür gehalten werden. Hält ein Verbraucher ein Erzeugnis deshalb für ein Arzneimittel, sieht er auch die dafür benutzte Marke als eine Benutzung für Arzneimittel an. Ein Präsentationsarzneimittel ist deshalb auch markenrechtlich ein Arzneimittel.
Zu entscheiden war deshalb nur noch, ob die Verbraucher die Weihrauchtabletten nach ihrem Erscheinungsbild für Arzneimittel hielten.
Wie man oben sieht, befanden sich auf der Verpackung die Angaben „TABLETS“, der Hinweis „AYURVEDIC MEDICINE“ und insbesondere auch die Indikationen verschiedener entzündlicher Erkrankungen, wie Ostheo arthritis, myositis, fibrositis. Ferner wurden die Produkte wegen der Gesetzeslage bei importierten nicht zugelassenen Arzneimitteln nur auf ärztliche Verschreibung hin in Apotheken verkauft. Alle diese Einzelheiten des Erscheinungsbildes erzeugten in ihrer Gesamtheit bei den Verbrauchern das arzneimitteltypische Vertrauen auf die pharmakologische Wirksamkeit der Tabletten.
Die Marke Gufic wurde folglich auch markenrechtlich für Arzneimittel benutzt und der Verfallsantrag wurde insoweit zurückgewiesen. Ob die Tabletten Funktionsarzneimittel waren und über eine pharmakologische Wirkung verfügten, ob ihr Vertrieb unzulässig war oder nicht, ob die Weihrauchtabletten bedenkliche Arzneimittel waren oder nicht, war für das Markenrecht nicht relevant. Hier geht es nur darum, ob die Marke für die registrierten Waren benutzt wurde. Das war, wie gezeigt, der Fall.
Hecht Pharma hat in der Sache zwar noch den Gerichtshof der Europäischen Union angerufen. Ob dieser allerdings das Verfahren aufgreift, ist aufgrund seiner bisherigen Praxis äußerst fraglich.
Gericht der Europäischen Union, 11. Januar 2023, T 346/21.
Learnings: Ein unbedachtes Warenverzeichnis kann sich rächen. Wenn Sie eine Marke für Nahrungsergänzungsmittel oder Kosmetikprodukte benutzen wollen, sollten Sie deshalb prüfen, ob die Produkte später nicht als Arzneimittel angesehen werden können. Maßgeblich hierfür ist die äußere Form und Aufmachung der Produkte. Verfügen Sie in solchem Falle über keinen Markenschutz auch für Arzneimittel, laufen Sie Gefahr, Ihre Produktmarke zu verlieren.